Psicofarmacoterapia con antipsicotici LAI: indicazioni operative condivise all’interno del Servizio Salute Mentale Adulti di Prato
Autori
* Coordinatore Medico Centro Salute Mentale U.F.C. S.M.A. Prato
** Scuola di Specializzazione in Psichiatria, Università di Firenze
*** Direttore U.F.C. S.M.A. Prato
Ricevuto il 28/11/2022 – Accettato il 10/12/2022
Riassunto
Il testo richiama le principali evidenze a supporto della terapia antipsicotica long-acting nel trattamento farmacologico della schizofrenia. Lo scopo è poi quello di fornire una panoramica sull’appropriatezza prescrittiva e sul monitoraggio dell’impiego di tali farmaci nei Servizi di salute mentale – sia in ragione del rilievo clinico-epidemiologico della patologia trattata, sia della necessità di integrare, nella valutazione sanitaria, la dimensione della corretta allocazione delle risorse.
Abstract
The present work refers to the main evidence supporting the prescription of long-acting injectable antipsychotics for the pharmacological treatment of schizophrenia. Moreover, the text aims to provide information on their appropriateness of use, and on the requested monitoring of these drugs in public mental health services – due to the clinical and epidemiological importance of the treated condition, and to the need for a proper use of public health resources.
Introduzione
Il trattamento antipsicotico di mantenimento con farmaci depot o long-acting è molto impiegato all’interno dei Servizi di salute mentale. Con il termine depot si fa usualmente riferimento alle formule a lento rilascio di antipsicotici di prima generazione (first generation antipsychotics, FGA), oggi rappresentati da aloperidolo decanoato e zuclopentixolo decanoato. Per i farmaci di seconda generazione (second generation antipsychotics, SGA) è maggiormente diffuso il termine LAI (acronimo di long-acting injectable), cui corrispondono i prodotti a base di risperidone microsfere, olanzapina pamoato, paliperidone palmitato (nella sua versione mensile e trimestrale), e aripiprazolo monoidrato.
Negli ultimi 15 anni, i LAI sono andati diffondendosi in modo crescente, congiuntamente alla raccolta di una serie di evidenze in favore del loro utilizzo, che è ad oggi sancito da autorevoli linee guida (National Institute for Clinical Excellence, NICE, 2014). Tali farmaci sono approvati per il trattamento farmacologico della schizofrenia (Graffino et al., 2014; Owen, Sawa & Mortensen, 2016) con crescenti evidenze relative all’uso all’interno dello spettro diagnostico, e in particolare nel disturbo schizoaffettivo (Pacchiarotti et al., 2019). Il loro impiego mira alla prevenzione delle ricadute, che sono state caratterizzate come eventi neurotossici, cui si associano progressione di malattia e incremento della disabilità associata (Emsley et al., 2013). Una riduzione della gravità e della frequenza delle riacutizzazioni è conseguita principalmente attraverso il superamento del problema della mancata aderenza ai trattamenti farmacologici (Kane, Kishimoto & Correll, 2013; Correll et al., 2016), e cioè del fatto che i pazienti con patologia psichiatrica grave e cronica spesso assumono in modo incostante la terapia.
La crescente attenzione ad approcci orientati alla recovery (Correll & Lauriello, 2020), ovvero al controllo della sintomatologia associato ad un miglioramento del funzionamento della persona e della sua qualità di vita, ha portato a suggerire un impiego relativamente precoce del trattamento LAI, laddove i farmaci depot erano storicamente usati come seconda linea nei pazienti che rifiutavano le cure, con una valenza potenzialmente coercitiva e stigmatizzante (De Risio & Lang, 2014). Questo diverso uso si fonda sull’idea che la prevenzione delle ricadute e delle relative conseguenze – quali ospedalizzazioni e compromissione del funzionamento sociale – può evitare soprattutto nelle fasi precoci l’instaurarsi di un circolo vizioso nella prognosi di queste persone.
Recentemente, a giustificazione dell’impiego dei LAI, sono emersi dati di rilievo dalla pratica clinica, che hanno suggerito in modo piuttosto chiaro una riduzione di outcomes negativi quali ricadute, ospedalizzazioni e mortalità per tutte le cause (Tiihonen et al., 2017; Huang et al., 2021; Ostuzzi et al., 2022). Ad oggi, la scelta della specifica molecola antipsicotica non avviene sulla base di comprovate differenze di efficacia – che risulta sovrapponibile nei pochi studi disponibili (Nielsen et al., 2015; Correll et al., 2016; Jann & Penzak, 2018; Ostuzzi et al., 2022) – quanto sulla tollerabilità soggettiva e oggettiva da parte del paziente. In questo contesto emerge una preferenza per i moderni LAI rispetto ai FGA depot, nonostante il costo maggiore dei primi – spesa che si traduce comunque in vantaggi farmaco-economici a lungo termine tramite la riduzione delle ospedalizzazioni e dei relativi costi sanitari (Kaplan, Casoy & Zummo, 2013). Oltretutto, già per i farmaci orali è emersa una maggiore tollerabilità soggettiva dei SGA, con ridotta disforia indotta da neurolettici: quest’ultima è una reazione avversa soggettiva correlata all’occupazione dei recettori D2 della dopamina (Naber et al., 2001; Naber, 2008), recettore responsabile anche di effetti avversi come parkinsonismo da farmaci e iperprolattinemia. Ciononostante, l’uso degli FGA è ancora molto frequente nella pratica clinica (Olfson, Marcus & Ascher-Svanum, 2007; Patel et al., 2010).
Poiché l’impatto benefico sulla prognosi emerge nel medio-lungo termine, è importante che l’allocazione di questa risorsa terapeutica sia limitata a casi selezionati in cui deve poi essere promossa la continuità delle cure. Quest’ultimo obiettivo, tuttavia, si mostra di non facile raggiungimento: infatti, quasi la metà dei pazienti che iniziano un trattamento LAI lo interrompono nei 12 mesi successivi (Rittmannsberger et al., 2017), soprattutto quando viene avviato in fase di acuzie (i.e., all’interno dell’S.P.D.C.). In pratica, la scelta di usare un LAI dovrebbe essere subordinata non esclusivamente al timore di una scarsa compliance, ma anche a una progettualità di lungo termine in cui si preveda di impiegare tale risorsa all’interno di interventi multidisciplinari e di rivalutazioni frequenti, soprattutto nei casi in cui i problemi di aderenza possono avere un impatto prognostico particolarmente nefasto (compromissione di percorsi riabilitativi, perdita di ruolo personale e sociale, etc.). Questa opportunità di monitoraggio è anche alla base dell’eventuale pratica di deprescription, ovvero lo scalaggio controllato della terapia LAI dopo un periodo adeguatamente lungo di controllo dei sintomi, in assenza di fattori di rischio per ricaduta, in un contesto in cui non sussistano sufficienti evidenze di un positivo rapporto-costi benefici legato alla somministrazione del LAI.
Per tali motivi di appropriatezza prescrittiva, ed in previsione delle contestuali necessità di monitoraggio, appare opportuno procedere a una revisione dei farmaci antipsicotici a lento rilascio attualmente in uso, valutandone al contempo l’utenza target, e ricordando che la farmacoterapia è solo uno degli interventi multidimensionali a supporto di queste persone.
Caratteristiche farmacologiche dei LAI
Quando in letteratura scientifica si parla di psicofarmacologia, lo si fa in genere per riferire quali sono le caratteristiche biochimiche (farmacodinamica, ovvero il meccanismo di azione della molecola; e farmacocinetica, ovvero come l’organismo processa il farmaco dall’assunzione all’eliminazione), ma anche l’efficacia e la tollerabilità dei principi attivi usati per un disturbo psichico (psicosi, depressione, ansia, etc.). La farmacologia delle molecole psicotrope, oltre a proporre nuove soluzioni dell’armamentario terapeutico, ha permesso di comprendere anche le anomalie del funzionamento di specifiche aree cerebrali che sono alla base della sintomatologia psichiatrica (per esempio l’eccesso di dopamina a livello del sistema meso-limbico nei sintomi psicotici della schizofrenia): detta in termini semplici, la psicofarmacologia ci indirizza a capire “quale sia la migliore molecola per uno specifico disturbo psichiatrico”.
Diversamente, la psicofarmacoterapia fa riferimento all’ordinaria pratica clinica, dove molto spesso l’operatore sanitario deve affrontare varie problematiche correlate alla cura del paziente con disturbi psichici. Ne sono esempi la gestione degli effetti collaterali, il modo di trattare una donna psicotica in gravidanza o un utente psichiatrico affetto da disturbi della conduzione cardiaca: ovvero, tutte quelle situazioni pratiche che impongono al clinico una scelta fra vari approcci terapeutici specifici per una determinata condizione clinica. In questo senso possiamo definire la psicofarmacoterapia come “il miglior modo per trattare uno specifico disturbo psichico”.
Gli antipsicotici hanno rappresentato un’enorme conquista nell’armamentario farmacoterapeutico delle psicosi croniche. Scoperti verso la metà del secolo scorso, sono rappresentati da molecole che agiscono in diversa proporzione su vari recettori del sistema nervoso centrale, come quelli di Dopamina (DA), Acetilcolina (ACh), Istamina (H), Noradrenalina (NA) e Serotonina (5-HT). La caratteristica farmacodinamica che accomuna tutti gli antipsicotici tradizionali è il blocco, a dosaggi terapeutici, dei recettori dopaminergici a livello dei sistemi meso-limbico, meso-corticale, nigro-striatale e tubero-infundibolare. Si ritiene che il blocco dei recettori per la dopamina a livello del sistema nigro-striatale sia responsabile degli effetti extrapiramidali, e che quello a livello tubero-infundibolare sia il principale determinante di iperprolattinemia, con ciò che ne consegue (disfunzione sessuale, osteoporosi, etc.). Di contro, il blocco degli stessi recettori a livello del sistema meso-limbico e meso-corticale sarebbe correlato all’azione antipsicotica: questo è vero soprattutto per il sistema meso-limbico, mentre a livello meso-corticale un eccessivo blocco dopaminergico può essere associato ad alcuni sintomi negativi secondari (p.e., riduzione della spinta volitiva ed appiattimento affettivo).
Gli antipsicotici atipici o SGA sono un gruppo di composti che si differenzia dagli antipsicotici tipici o FGA per un diverso profilo recettoriale: minore affinità per i recettori dopaminergici a livello nigro-striatale e tubero-infundibolare (con riduzione di effetti extrapiramidali e iperprolattinemia), maggiore selettività per i recettori dopaminergici a livello meso-limbico e meso-corticale (con riduzione dei sintomi negativi secondari nonostante un’efficacia comparabile sui sintomi psicotici), e maggiore affinità per i recettori della serotonina 5-HT2A/C (il cui blocco contribuisce all’attività antipsicotica).
I primi depot sono stati introdotti nella pratica clinica a metà degli Anni ’60 dello scorso secolo, con l’immissione in commercio di flufenazina enantato e flufenazina decanoato prima, e di aloperidolo decanoato poi. Queste formulazioni sono basate sull’esterificazione del principio attivo con acidi grassi a catena lunga disciolti in soluzione oleosa, ed il loro uso è gravato da una marcata incidenza di effetti collaterali di tipo extrapiramidale e di iperprolattinemia, nonché da un maggior tasso di effetti avversi in sede di iniezione dovuti al mezzo oleoso. Poiché la non aderenza ai trattamenti ha rappresentato un rilevante problema anche con le formulazioni orali di SGA – nonostante il loro impatto positivo sugli effetti collaterali di tipo extrapiramidale, a spese tuttavia di maggiori effetti di tipo metabolico – sono poi state sviluppate formulazioni LAI di questi ultimi (Tabelle 1-2).
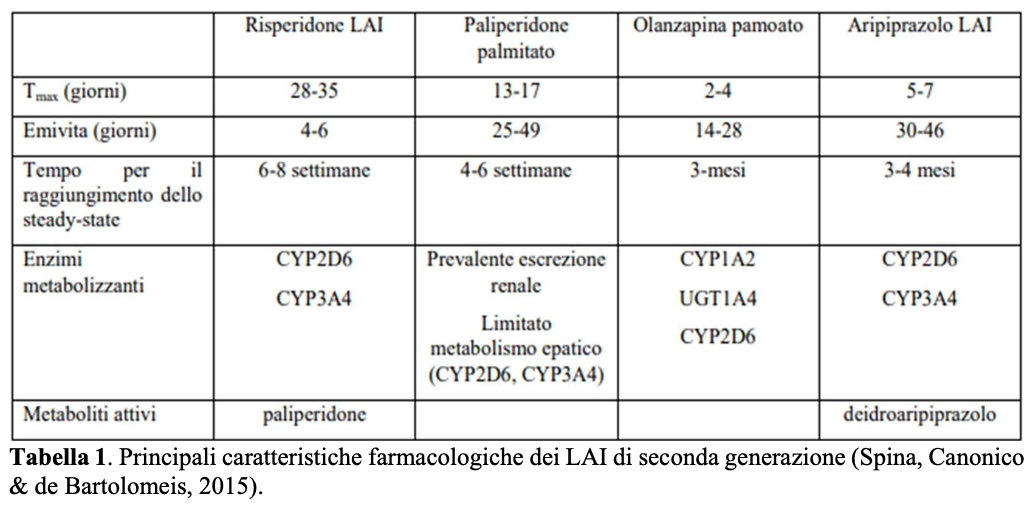
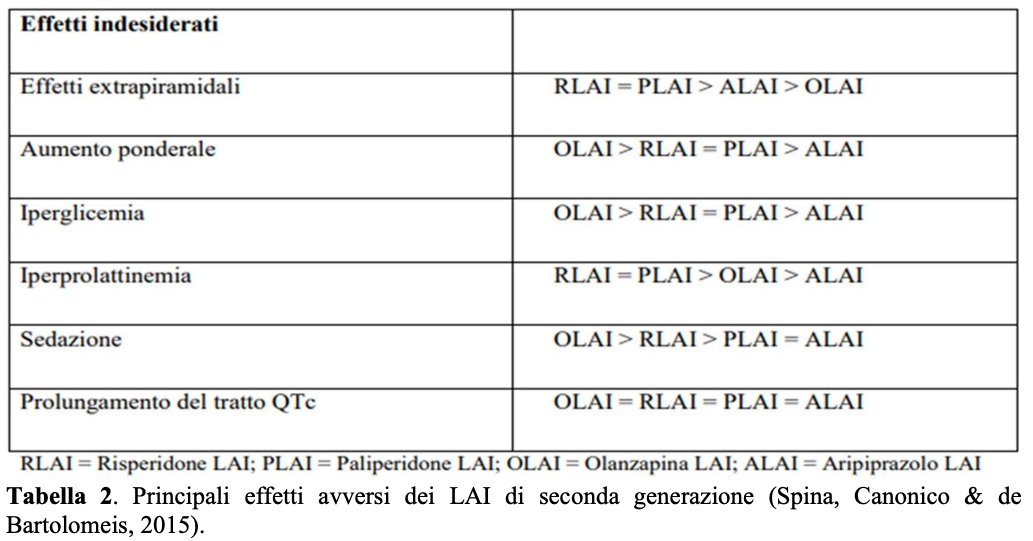
Confronto fra antipsicotici LAI ed orali
Gli studi che hanno confrontato le formulazioni LAI con le formulazioni orali non hanno inizialmente fornito risultati attendibili a causa di possibili problemi metodologici (Cristarella et al., 2022), e per il fatto che i pazienti arruolati negli studi randomizzati controllati sono poco rappresentativi dei pazienti del “mondo reale” (cosiddetta real-world practice). Sono infatti spesso pazienti privi di comorbilità (p.e., il frequente uso di sostanze è un criterio di esclusione da molti studi), e sufficientemente compensati e aderenti alle cure da partecipare ai trial (Haddad et al., 2015). Diversamente, gli utenti che accedono ai Servizi presentano in varia misura questi elementi di complessità. Più indicativi, pertanto, sono gli studi “mirror-image” (immagine riflessa) in cui il paziente è osservato prima e dopo il passaggio da orale a LAI: questo disegno di studio è il primo ad aver evidenziato una superiorità delle preparazioni LAI nel prevenire le ricadute, le ospedalizzazioni e outcome negativi inclusa la mortalità per tutte le cause (Huang et al., 2021). Recentemente, tuttavia, la maggiore efficacia dei LAI rispetto alla controparte orale è stata confermata anche in una metanalisi di studi randomizzati controllati (Ostuzzi et al., 2022).
Vantaggi della terapia con antipsicotici LAI
Dalla letteratura emerge che ad ogni ricaduta psicotica i pazienti vanno incontro ad alterazioni strutturali e funzionali del sistema nervoso centrale su base neurotossica (Emsley et al., 2013), il che giustifica la necessità di un trattamento farmacologico precoce e continuativo (NICE, 2014). Il razionale per l’uso appropriato di un antipsicotico LAI poggia sui seguenti aspetti:
- migliorare l’aderenza al trattamento farmacologico: diversi studi evidenziano che più del 50% dei pazienti affetti da schizofrenia hanno una parziale o totale non aderenza al trattamento prescritto per via orale; diversamente nei pazienti ambulatoriali con schizofrenia o disturbo schizoaffettivo il trattamento con LAI è associato a una percentuale di aderenza al trattamento più elevata (superiore al 70% in diversi studi);
- migliorare il profilo farmacocinetico: dopo somministrazione di una formulazione LAI, le concentrazioni plasmatiche del farmaco sono ritenute più stabili rispetto alla formulazione orale, con potenziali vantaggi dal punto di vista clinico e in particolar modo della tollerabilità; questo perché un’elevata differenza tra concentrazioni di picco e minime può associarsi ad effetti collaterali (p.e., iperprolattinemia) e a ridotta copertura terapeutica.
Svantaggi della terapia con antipsicotici LAI
Da quanto detto precedentemente, occorre comunque tenere presente che il trattamento con una formulazione LAI richiede particolare attenzione rispetto ad un trattamento con formulazioni per via orale. Prima di tutto, il paziente che si sottopone all’iniezione mensile o trimestrale non deve assolutamente avere la sensazione di essere “stigmatizzato” (l’iniezione mensile nell’immaginario comune è considerata come una terapia “ultima spiaggia” per un problema patologico grave, ovvero una sorta di “non ritorno” ad una qualità di vita migliore). D’altro canto, il paziente che si sottopone mensilmente all’iniezione o peggio ancora che si presenta al Servizio per una somministrazione trimestrale potrebbe vivere la propria condizione di malattia in modo ancora più frustrante, sentendosi “scaricato” dai curanti, relegando il programma ad una semplice somministrazione periodica.
Inoltre, è da ricordare l’entità dei costi di questi trattamenti, che risulta tale da sollevare problemi di ordine farmaco-economico: infatti, una singola fiala di LAI di nuova generazione costa alcune centinaia di euro, per cui non è difficile immaginare l’impatto negativo sulla spesa sanitaria in caso di un uso indiscriminato e inappropriato di questa risorsa. Per tale motivo, alcuni Servizi hanno imposto un tetto di spesa per questi presìdi, con il rischio di influenzare la prassi clinica (p.e., difficoltà di prescrizione ad un utente che ne trarrebbe reale beneficio poiché la risorsa è stata saturata da un paziente che avrebbe modo di essere compliante a un trattamento orale). Di contro, un uso oculato dei principi di appropriatezza e monitoraggio può consentire di evitare questo genere di misure, mentre un impiego mirato dei LAI può addirittura ridurre la spesa sanitaria complessiva (Kaplan, Casoy & Zummo, 2013; Correll et al., 2016). Questo perché nei costi diretti del trattamento della schizofrenia figurano quelli – almeno in parte evitabili – di ricadute e ospedalizzazioni, per non parlare di quelli indiretti legati ai periodi di malattia e di interruzione del lavoro degli utenti: la spesa farmaceutica, in effetti, è pari a circa il 10% dei costi sanitari complessivamente associati alla schizofrenia (Marcellusi et al., 2018), dove ricoveri ed inserimento in percorsi residenziali rappresentano i maggiori capitoli di spesa dei percorsi di cura. Per gli stessi motivi, comunque, dopo un periodo di adeguata stabilizzazione clinica è possibile rivalutare la posologia e la necessità del trattamento LAI (cosiddetta deprescription) alla luce del rapporto costi-benefici. I vantaggi e svantaggi della terapia LAI sono riassunti in Tabella 3.
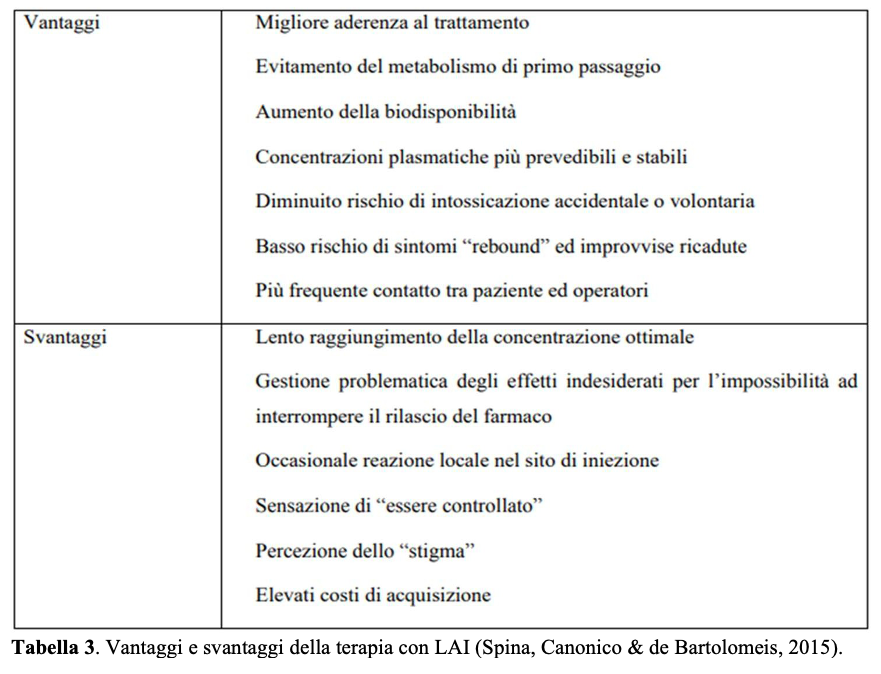
Indicazioni prescrittive
Per quanto riguarda la prescrizione dei LAI di seconda generazione, tali formulazioni sono indicate esclusivamente per il trattamento della schizofrenia dopo che siano state saggiate la tollerabilità ed efficacia, e (per alcuni prodotti) sia stata conseguita la stabilizzazione clinica con trattamento orale. In questo differiscono dalla loro controparte per os, in particolare per risperidone, aripiprazolo ed olanzapina, le cui indicazioni sono estese anche al trattamento e/o alla prevenzione dell’episodio maniacale. In modo diverso, invece, gli FGA in formulazione depot hanno delle indicazioni più flessibili.
Per quanto detto, possiamo sintetizzare che la decisione di avviare un paziente alla terapia con farmaci antipsicotici LAI si fonda su alcuni elementi essenziali:
- il riconoscimento dell’esistenza di una patologia per la quale tale trattamento è indicato; in questo caso l’indicazione è la schizofrenia;
- la sussistenza di criteri che suggeriscono il passaggio dalla terapia orale a quella con LAI, quali:
- un’insufficiente efficacia della terapia orale che sia ascrivibile a un uso improprio o ridotto della terapia orale (viceversa, se l’assunzione per os è corretta, non necessariamente avremo cambiamenti sostanziali con il passaggio a LAI);
- una scarsa aderenza del paziente alla terapia orale;
- un abnorme investimento emotivo o manipolazione da parte del paziente della terapia orale o viceversa una preferenza del paziente stesso per la terapia LAI (ciò è confermato dalle linee guida, ricordando che per alcuni utenti può essere più stigmatizzante assumere compresse ogni giorno) (NICE, 2014);
- necessità di dosi alte o eccessivi effetti collaterali con la formulazione orale (infatti, per la maggior disponibilità delle formulazioni iniettive LAI è possibile utilizzare dosaggi più bassi che con la formulazione orale).
Monitoraggio del trattamento LAI e farmacovigilanza
Come per ogni trattamento psicofarmacologico, anche i LAI richiedono una valutazione periodica dell’appropriatezza prescrittiva ed un monitoraggio dei loro effetti terapeutici e avversi nel tempo. Tale valutazione deve tenere conto di fattori psicosociali e medici di ordine più generale, così da poter condurre un’esaustiva analisi del rapporto costi-benefici. Ad esempio, le persone affette da schizofrenia, oltre ad avere un aumentato rischio di suicidio, sono esposte anche all’insorgenza di malattie mediche con un aumento del tasso di mortalità standardizzato per età fino a 2-3 volte rispetto alla popolazione generale. Molte di queste malattie mediche non sono adeguatamente diagnosticate e trattate, anche a causa della frequente auto-trascuratezza legata alla patologia di base: l’aspettativa di vita di un paziente affetto da schizofrenia è circa 26 anni inferiore alla popolazione generale (Laursen et al., 2014). L’aumento ponderale e l’obesità costituiscono un problema clinico frequentemente associato a condizioni mediche come l’ipertensione, il diabete mellito, la dislipidemia e le coronaropatie. Studi clinici ed epidemiologici suggeriscono che le persone affette da schizofrenia mostrano una percentuale più elevata di aumento ponderale, obesità e diabete rispetto ad appropriate popolazioni di controllo. Alcuni antipsicotici, soprattutto fra quelli di seconda generazione, sono associati ad un elevato rischio di aumento ponderale e ad un’alterazione del controllo glicemico (in particolare quetiapina e olanzapina). Proprio per i motivi sopra accennati è condizione essenziale che il paziente in trattamento con LAI sia monitorato più attentamente con visite a cadenza regolare (Mitchell et al., 2013; NICE, 2014) al fine di ottenere un accurato monitoraggio di diversi fattori. Presentiamo qui un elenco, non esaustivo, ma rappresentativo dei più frequenti problemi clinici:
- alterazioni della pressione arteriosa (rischio di ipotensione ortostatica in particolare con risperidone, paliperidone, aloperidolo e clozapina; rischio di ipertensione secondario ad aumento ponderale);
- alterazioni della funzionalità cardiaca (rischio di tachicardia e miocardite con clozapina, rischio di aritmie ventricolari maligne soprattutto con aloperidolo);
- variazioni dell’indice di massa corporea (rischio di incremento ponderale soprattutto con quetiapina e olanzapina);
- alterazioni di del profilo glicemico e lipidico, tenendo sempre a mente che l’impatto di questa tipologia di psicofarmaci ha sul profilo metabolico e cardiovascolare, motivo per il quale gli operatori sanitari dovrebbero essere indotti ad assistere il paziente in un’ottica la più ampia possibile, prendendosi cura nel modificare il suo stile di vita (alimentazione, attività fisica, lavorativa, etc.);
- iper-prolattinemia, soprattutto legata ad aloperidolo, risperidone e paliperidone, in quanto un rialzo cronico può alterare la funzionalità sessuale, favorire l’insorgenza di osteoporosi ed entrare in diagnosi differenziale con masse secernenti prolattina, ancorché benigne.
Queste ed altre situazioni richiedono un monitoraggio periodico mediante prescrizione di approfondimenti clinici ed ematochimici sanciti dalle autorità regolatorie europee e locali.
Inoltre, data la peculiare farmacocinetica dei LAI, deve essere valutata la possibilità alcuni effetti avversi dei LAI possano persistere, rispetto alla controparte orale, per tempi relativamente maggiori dopo la sospensione o le variazioni posologiche dei farmaci interessati, dato particolarmente rilevante per i sintomi extrapiramidali persistenti, su cui sono tuttavia disponibili pochi dati (Gopal et al., 2014; Omi, Mitsui & Matsunaga, 2018).
Conclusioni e prospettive
In chiusura, riteniamo opportuno sottolineare una volta di più il fatto che il trattamento con LAI deve far parte di una presa in carico del paziente e non di una semplice presa in cura, il che porta imprescindibilmente all’attivazione di un PTRI in cui la scelta di usare un farmaco LAI deve essere fondamentalmente condivisa con il paziente (cosiddetto shared-decision making). Allo stesso modo, poiché un LAI viene di norma effettuato per lunghi periodi, il suo uso non deve chiudere le porte ad un’eventuale riduzione della posologia (cosiddetta deprescription), per cui il monitoraggio clinico serve anche a rivalutare periodicamente la necessità del trattamento e della dose. Un’insufficiente compliance del paziente è frequente nelle psicosi, e scaturisce largamente da specifiche dinamiche della patologia stessa. Tuttavia, può dipendere anche dal vissuto di malattia e da fenomeni organizzativi e logistici, come dimostrato dal fatto che si presenta in numerose patologie croniche non psichiatriche, incluse le malattie metaboliche e cardiovascolari. Risulta pertanto fondamentale che alla farmacoterapia siano associate strategie relazionali che consentano di affrontare il problema nei suoi aspetti di significazione emozionale e di donazione di senso, ma anche di analisi delle necessità organizzative e della fruibilità dei trattamenti. In altre parole, il trattamento con LAI non deve rappresentare una strategia per eludere il confronto con le dinamiche del paziente, ma piuttosto una strategia di semplificazione della psicofarmacoterapia tanto rispetto al progetto terapeutico globalmente inteso, quanto rispetto al progetto esistenziale della persona. Da queste considerazioni è necessario ipotizzare un modello di intervento globale che veda al centro la relazione medico-paziente, ed in cui la dimensione psicofarmacoterapeutica è supportata da una rete multidimensionale di interventi collaterali (terapie di gruppo, psicoterapie individuali, interventi socio-assistenziali, percorsi psico-sociali, etc.) improntati alle possibilità di interventi di cura capaci di modificare in maniera sostanziale i percorsi di vita.
Bibliografia
Correll CU, Citrome L, Haddad PM, et al. The Use of Long-Acting Injectable Antipsychotics in Schizophrenia: Evaluating the Evidence. J Clin Psychiatry. 2016;77(S3):1-24.
Correll CU, Lauriello J. Using Long-Acting Injectable Antipsychotics to Enhance the Potential for Recovery in Schizophrenia. J Clin Psychiatry. 2020;81(4).
Cristarella T, Castillon G, Nepveu J-F, Moride Y. Impact of schizophrenia relapse definition on the comparative effectiveness of oral versus injectable antipsychotics: A systematic review and meta-analysis of observational studies. Pharmacol Res Perspect. 2022;10(1):e00915.
De Risio A, Lang AP. History and therapeutic rationale of long-acting antipsychotics. Curr Clin Pharmacol. 2014;9(1):39-52.
Emsley R, Chiliza B, Asmal L, Harvey BH. The nature of relapse in schizophrenia. BMC Psychiatry. 2013;13:50.
Gopal S, Xu H, Bossie C, Burón JA, Fu DJ, Savitz A, Nuamah I, Hough D. Incidence of tardive dyskinesia: a comparison of long-acting injectable and oral paliperidone clinical trial databases. Int J Clin Pract. 2014;68(12):1514-22.
Graffino M, Montemagni C, Mingrone C, Rocca P. Antipsicotici a rilascio prolungato nel trattamento della schizofrenia: una revisione della letteratura. Riv Psichiatr. 2014;49(3):115-23.
Huang C-Y, Fang S-C, Shao Y-HJ. Comparison of Long-Acting Injectable Antipsychotics With Oral Antipsychotics and Suicide and All-Cause Mortality in Patients With Newly Diagnosed Schizophrenia. JAMA Netw Open. 2021;4(5):e218810.
Jann MW, Penzak SR. Long-Acting Injectable Second-Generation Antipsychotics: An Update and Comparison Between Agents. CNS Drugs. 2018;32(3):241-257.
Leucht S., Cipriani A., Spineli L. et al. (2013). Comparative efficacy and tolerability of 15 antipsychotic drugs in schizophrenia: a multiple-treatments meta-analysis. Lancet. 382 (9896), 951-962.
Kane JM, Kishimoto T, Correll CU. Non-adherence to medication in patients with psychotic disorders: epidemiology, contributing factors and management strategies. World Psychiatry. 2013;12(3):216- 226.
Kaplan G, Casoy J, Zummo J. Impact of long-acting injectable antipsychotics on medication adherence and clinical, functional, and economic outcomes of schizophrenia. Patient Prefer Adherence. 2013;7:1171-1180.
Laursen TM, Nordentoft M, Mortensen PB. Excess Early Mortality in Schizophrenia. Annu Rev Clin Psychol. 2014;10(1):425–48.
Marcellusi A, Fabiano G, Viti R, Francesa, et al. Economic burden of schizophrenia in Italy: a probabilistic cost of illness analysis. BMJ Open. 2018;8(2):e018359.
Mitchell AJ, Vancampfort D, Sweers K, et al. Prevalence of metabolic syndrome and metabolic abnormalities in schizophrenia and related disorders: a systematic review and meta-analysis. Schizophr Bull. 2013;39(2):306–18.
Naber D. Subjective effects of antipsychotic drugs and their relevance for compliance and remission. Epidemiol Psichiatr Soc. 2008;17:174-176.
Naber D, Moritz S, Lambert M, et al. Improvement of schizophrenic patients’ subjective well-being under atypical antipsychotic drugs. Schizophr Res. 2001;50:79-88.
National Institute for Clinical Excellence (NICE). Clinical Guideline 178. Psychosis and schizophrenia in adults: prevention and management. Available at: https://www.nice.org.uk/guidance/cg178. Published 2014. Accessed November 28, 2022.
Nielsen J, Jensen SO, Friis RB, Valentin JB, Correll CU. Comparative effectiveness of risperidone long-acting injectable vs first-generation antipsychotic long-acting injectables in schizophrenia: results from a nationwide, retrospective inception cohort study. Schizophr Bull. 2015;41(3):627-36.
Olfson M, Marcus SC, Ascher-Svanum H. Treatment of Schizophrenia With Long-Acting Fluphenazine, Haloperidol, or Risperidone. Schizophr Bull. 2007;33:1379-1387.
Omi T, Mitsui Y, Matsunaga H. Long-acting formulation leading to severe long-term adverse effects: a case report of fluphenazine and persistent extrapyramidal symptoms. J Clin Pharm Ther. 2018;43(1):117-120.
Ostuzzi G, Bertolini F, Tedeschi F, et al. Oral and long-acting antipsychotics for relapse prevention in schizophrenia-spectrum disorders: a network meta-analysis of 92 randomized trials including 22,645 participants. World Psychiatry. 2022;21(2):295-307.
Owen MJ, Sawa A, Mortensen PB. Schizophrenia. Lancet. 2016;388(10039):86-97.
Pacchiarotti I, Tiihonen J, Kotzalidis GD, Verdolini N, Murru A, Goikolea JM, Valentí M, Aedo A, Vieta E. Long-acting injectable antipsychotics (LAIs) for maintenance treatment of bipolar and schizoaffective disorders: A systematic review. Eur Neuropsychopharmacol. 2019;29(4):457-470.
Patel MX, Haddad PM, Chaudhry IB, McLoughlin S, Husain N, David AS. Psychiatrists’ use, knowledge and attitudes to first- and second-generation antipsychotic long-acting injections: comparisons over 5 years. J Psychopharmacol. 2010;24:1473-1482.
Rittmannsberger H, Rosenleitner J, Malsiner-Walli G, Werl R, Rittmannsberger B, Yazdi K. Treatment Duration With Long-Acting Injectable Antipsychotics After In-hospital Initiation: A Retrospective Cohort Study. J Clin Psychopharmacol. 2017;37:250-254.
Spina E, Canonico PL, de Bartolomeis A. SIF Position Paper - Antipsicotici iniettabili a lunga durata d'azione nel trattamento della schizofrenia. Published 2015. Available at: https://sif-website.s3.amazonaws.com/uploads/document/attachment/3/sif_position_paper_antipsicotici_lai_lug15.pdf. Accessed November 28, 2022.
Stahl S, Psicofarmacologia essenziale. Guida alla prescrizione (Edizione Italiana 2019).
Tiihonen J, Mittendorfer-Rutz E, Majak M, et al. Real-World Effectiveness of Antipsychotic Treatments in a Nationwide Cohort of 29 823 Patients With Schizophrenia. JAMA Psychiatry. 2017;74(7):686-693.
